Vor einer Implantatversorgung gibt es viele Fragen. Wünscht der Patient Implantate, gilt es zunächst, aufgrund der Befunde zahnerhaltende Alternativen abzuklären. Eine Implantation muss medizinethisch vertretbar sein. Patienten werden dann über Risiken informiert und es werden ihre Belastbarkeit, ihr zeitliches und finanzielles Budget und ihre Bereitschaft zu geeigneter Mundhygiene ermittelt. Ist alles im grünen Bereich, kann die Diagnostik und Planung eingeleitet werden. Bei einfacher Prothetik und gutem Gewebeangebot kann dies überschaubar sein. In komplizierteren Fällen ist eine Kooperation oder Überweisung an erfahrene Kollegen angezeigt.
Kontraindikationen meist relativ
Nach Schätzung der Deutschen Gesellschaft für Implantologie (DGI) hat jeder dritte Patient älter 25 Jahre mindestens einen Risikofaktor. In der Regel leiten sich daraus nur relative Kontraindikationen ab, zum Beispiel bei Xerostomie, oralem Lichen planus, Lupus erythematodes oder Weichgewebsarthritis. Häufigere Erkrankungen, bei denen je nach Schwere und individueller Situation abgewogen werden muss, sind Blutgerinnungsstörungen, Herz-Kreislauf-Erkrankungen, Diabetes und Osteoporose. Zu den beiden Letzteren liegen bereits Leitlinien auf hohem wissenschaftlichem Niveau vor [1, 2]. Eine aktuelle Übersicht zu medizinischen und medikamentösen Risikofaktoren enthält die April-Ausgabe der Quintessenz Zahnmedizin [3].
Hohes Alter ist keine Kontraindikation für Implantate [4]. Ob Rauchen ein Risikofaktor für Periimplantitis ist, kann nach aktueller Datenlage nicht eindeutig beantwortet werden [5]. Eine Parodontitis in der Vorgeschichte und schlechte Mundhygiene erhöhen dagegen eindeutig das Risiko (Abb. 1) [6]. Das Gleiche gilt für Bruxismus [7]. In Bezug auf den Risikofaktor Hardware empfiehlt die DGI, nur Implantate mit dokumentiertem Langzeiterfolg zu verwenden. Dies würde allerdings bedeuten, dass nur noch länger eingeführte Produkte gekauft werden dürfen. Informationen zum Thema liefert auch die Seite www.cleanimplant.com
Weitere wichtige Faktoren, welche die Prognose von Implantaten beeinflussen, sind eine gute Ausbildung und ausreichend Erfahrung [8]. Curricula bieten Theorie und vorklinische Übungsmöglichkeiten. Training am Patienten gibt es fast ausschließlich in entsprechend aufgestellten Praxen oder Kliniken.
Zähne haben bessere Prognose als Implantate
„Implantate sollten nur verwendet werden, um hoffnungslose Zähne zu ersetzen.“ Mit diesem Statement steckte Prof. Dr. Dr. Anton Sculean (Bern) auf dem DGI-Kongress 2018 sehr klar ab, wo Implantate indiziert sind. Die Prognose von Zähnen ist laut Literatur besser als die von Implantaten [9]. „Strategische Extraktionen“ haben daher laut Sculean „keinerlei Berechtigung“.
Wann ein Zahn hoffnungslos ist, wird in der Praxis sehr unterschiedlich ausgelegt. Dazu der Chefredakteur des „International Journal of Oral Implantology“ (Quintessence Publishing), Craig Misch, DDS, MDS: „Die Schwelle, Zähne zu entfernen, ist niedriger geworden, und einige Kollegen haben das Interesse verloren, natürliche Zähne zu behandeln …“. Die Extraktion aller verbleibenden Zähne und deren implantatgetragener Ersatz solle erst nach „sorgfältiger Abwägung … von Nutzen und Risiken, Prognose und Alternativen“ erfolgen [10, 11]. Einen Leitfaden zur prognostisch sehr wichtigen Nachsorge implantatgetragener Ganzkieferversorgungen finden Sie hier (auf Englisch).
Knochenvolumen zuverlässig bestimmen
Mit immer kürzeren und schmaleren Implantaten wird versucht, horizontale oder vertikale Augmentationen zu vermeiden (Abb. 2 a-d). Damit Implantate sicher osseointegrieren und langfristig stabil bleiben, muss aber ausreichend Knochen- und Weichgewebe vorhanden sein. Um die Knochenhöhe zum Beispiel über dem Kanal des Nervus alveolaris inferior zu ermitteln, kann zweidimensionales Röntgen in Verbindung mit klinischer Diagnostik ausreichen, wobei die Ergebnisse je nach Studie abweichen [12, 13]. Bei einfacheren Fällen eignen sich im nächsten Schritt konventionelle Bohrschablonen. Das präzise Einbringen von Implantaten ist aber zum Beispiel bei Unterkiefern mit sanduhr- oder s-förmigem Querschnitt erschwert [14].
In diesen Fällen, bei komplexeren Situationen oder hohen ästhetischen Anforderungen kann ein Digitales Volumentomogramm (DVT) angezeigt sein [15], auch um geführte Implantationsverfahren zu ermöglichen [16]. Damit scheint sich die Häufigkeit von Augmentationen reduzieren zu lassen [17]. Knochendimensionen und geeignete Implantatabmessungen können mit DVT in der Regel zuverlässig ermittelt werden [18, 19]. Zu bedenken ist, dass die Messgenauigkeit bei dünnen Knochenlamellen begrenzt ist [20]. Um Knochen und Weichgewebe zum Beispiel in der Oberkieferfront zuverlässig zu trennen, ist zudem eine relativ hohe Strahlendosis erforderlich. Soll die Knochendichte vor Sofortimplantationen oder Sofortversorgungen bestimmt werden, sind nicht alle DVT-Geräte ausreichend präzise (Abb. 3a/3b) [21].
Zukunft Ultraschall und MRT?
Die Indikation zu einem DVT ist nach dem ALADA-Prinzip sorgfältig zu prüfen. Das bedeutet, die radiologische Belastung muss so niedrig sein wie möglich und diagnostisch sinnvoll, auch in Bezug auf altersbezogene oder individuelle Strahlenempfindlichkeit. Entsprechende deutsche Leitlinien sind leider seit Längerem veraltet [22, 23], Aktualisierungen sind für Ende 2020 (DVT) und 10/2021 (computergestützte Implantation) angekündigt.
Beim Gerät sollte unbedingt auf hohe Bildqualität bei geringer Strahlenbelastung geachtet werden. Einzustellen sind ein möglichst kleines Untersuchungsvolumen, bei hohem Spannungswert und minimal erforderlicher Stromstärke [24, 25]. Artefakte beeinträchtigen den diagnostischen Wert von DVT-Aufnahmen – bei vorhandenen Zirkonoxid-Implantaten stärker als bei Titan [26, 27]. Trotz bestehender Einschränkungen ist die Positionsgenauigkeit bei voll geführter (3-D-)Implantation höher als mit freihändiger Implantation [28–30]. Unterschiede in Implantatprognose oder Komplikationsrate wurden zwischen beiden Methoden nicht gefunden [30–32].
Räumliche Ausdehnung und Dicke von Weichgeweben unterscheiden sich beim selben Patienten je nach Zahn und dessen Position im Zahnbogen. Das wirkt sich auf die periimplantären Dimensionen aus, die zusätzlich von Implantatorientierung im Situs, Hardware und augmentativen Maßnahmen abhängen [33]. Auch ist ein definierter Phänotyp („Biotyp“) mit klinischen Methoden schwierig bestimmbar [34–36]. Der Implantationsbereich wird daher am besten selektiv, zum Beispiel mit Sondierung oder bildgebenden Verfahren untersucht [37, 38].
Als strahlenfreie Alternativen zum DVT könnten sich in Zukunft Ultraschall oder Magnetresonanztomografie (MRT) etablieren. Ultraschall dürfte dabei primär für kleinräumige Knochen- und Weichgewebsdiagnostik um Zähne und Implantate interessant sein [39, 40]. MRT erscheint dagegen auch für die primäre Diagnostik größerer Areale oder, nach Matching mit Oberflächen-Scans, für geführte Implantationen geeignet und hat damit erhebliches Potenzial (Abb. 4) [41, 42]. Ein spezielles MRT-Gerät für zahnmedizinische Indikationen ist nach internen Informationen zum Patent angemeldet, aber bisher nicht kommerziell verfügbar.
Vielfältige prothetische Wege
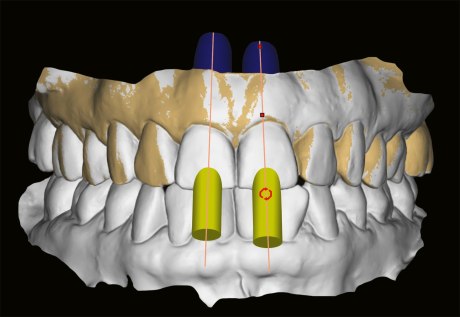
Für die Aufzeichnung intra- und extraoraler Oberflächen und räumlicher Verhältnisse eignen sich neben den analogen (plastische Abformungen, Modelle, Fotos) auch digitale Methoden. So lässt sich die Ausgangssituation mit einem intraoralen Scanner aufnehmen, die Daten für die prothetische Planung können in eine CAD/CAM-Software importiert werden (Abb. 5). Dort planen Zahntechniker zum Beispiel temporäre Versorgungen, die nach Möglichkeit direkt nach der Implantation eingegliedert werden. Durch Abgleich (Matching) mit einem DVT-Datensatz können auch Bohrschablonen, definitive Sofort-Abutments und Gingivaformer geplant und am Implantationstag geliefert werden. Sehr wichtig ist hier wiederum ein sorgfältiges und strukturiertes Vorgehen [43], das auf der Basis von Anwenderinformationen durch validierte Produktsysteme erleichtert wird.
Die Präzision intraoraler Scans ist – allerdings abhängig von Anwendererfahrung und verwendetem Gerät – auch für ganze Kiefer bereits recht gut [44, 45]. Das gilt, bei noch recht dünner Datenlage, auch für die digitale Positionsbestimmung von Implantaten (Abb. 6) [46]. Präzisionsvorteile scheinen hier Scan-Abutments mit speziell vergrößerter Form zu haben, wobei offene plastische Abformungen die besten Ergebnisse erzielten [47].
Um das Durchtrittsprofil von Abutments und Restaurationen funktionell, ästhetisch und mundhygienisch optimal zu gestalten, wird ein breites Spektrum analoger und digitaler Workflows praktiziert. Meist handelt es sich um Mischformen mit Elementen beider Wege [48]. Eine relativ neue Alternative ist das Einbringen konfektionierter Hybrid-Abutments, die im Mund beschliffen und dann analog oder digital abgeformt werden (Abb. 7, 8a/8b) [49]. Die Position des Implantats und – darauf abgestimmt – des Abutments wird computergestützt oder intraoperativ durch Orientierung an den Nachbarzähnen ausgewählt.
Ein wichtiger Planungsfaktor, der sich auf den Erfolg von Implantaten und darauf verankerter Prothetik auswirkt, ist die Funktion. Diese wird in einem speziell diesem Thema gewidmeten Fachbuch diskutiert [50]. Auch hier nehmen digitale Methoden Einzug, unter anderem durch opto-elektronische Aufzeichnung von Exkursionsbewegungen oder Relationsbestimmung mit Bohrschablone und digitaler Implantat-Positionsbestimmung für Ganzkieferversorgungen [51].
Fazit und Ausblick
Die Feststellung, dass erfolgreiche Implantatversorgungen eine gute Planung erfordern, bedeutet Eulen nach Athen zu tragen. Noch vor wenigen Jahren geltende Empfehlungen renommierter Institutionen entsprechen aber nur noch eingeschränkt dem Stand der Technik und sollten regelmäßig hinterfragt werden [52, 53)]. Dies erfolgt einerseits in der klinischen Routine im Austausch mit versierten Zahntechnikern und Industriepartnern, aber auch über Fortbildung und die Fachliteratur. Welche Rolle dabei digitale Methoden heute und in der Zukunft einnehmen werden, hängt von ihrer Bewährung im Alltag und ihrer Bezahlbarkeit ab. Im Zentrum müssen dabei, wie bei allen Therapieformen, die klinische Indikation und das Interesse der Patienten stehen.
Dr. Jan H. Koch
Für eilige Leser
Befunden, diagnostizieren, planen – was ist wichtig?
1. Vor jeder Implantatbehandlung muss die Indikation geklärt sein.
2. Risikofaktoren sind differenziert zu betrachten, Kontraindikationen daher meist relativ.
3. Zweidimensionales Röntgen und konventionelle Bohrschablonen sind in einfacheren Fällen ausreichend.
4. Dreidimensionales Röntgen (DVT) kann bei anatomischen Besonderheiten zur Abklärung von Augmentationsbedarf und für spezielle Konzepte angezeigt sein.
5. Ultraschall und Magnetresonanztomografie könnten bald strahlenfreie Diagnostik von Hart- und Weichgeweben ermöglichen.
6. Intraorale Scans (IOS) ermöglichen digitale Sofortversorgungskonzepte mithilfe computergestützter geführter Implantation.
7. Für bis zu dreigliedrige Implantatversorgungen lassen sich die Positionen präzise mit IOS bestimmen, bei größeren ist die Genauigkeit geringer.
8. Für die Prothetik wird eine große Bandbreite analoger, digitaler und hybrider Workflows realisiert.
9. Wichtig ist bei allen diagnostischen und Planungsschritten, die Daten sorgfältig und strukturiert zu gewinnen und auszuwerten.
Hinweis
Beiträge in der Rubrik ZahnMedizin kompakt können in keinem Fall die klinische Einschätzung des Lesers ersetzen. Sie sind keine Behandlungsempfehlung, sondern sollen – auf der Basis aktueller Literatur – die eigenverantwortliche Entscheidungsfindung unterstützen.
Literatur
1. DGI, DGZMK; S3-Leitlinie AWMF; Registernummer 083 - 026; gültig bis 30.07.2021; http://www.awmf.org/leitlinien/detail/ll/083-026.html
2. DGI, DGZMK. S3-Leitlinie AWMF; Registernummer 083 - 025; gültig bis 30.08.2021; http://www.awmf.org/leitlinien/detail/ll/083-025.html . 2016.
3. Kozik, J., et al.; Quintessenz 2020. 71 (4): 384-393.
4. Schimmel, M., et al.; Clin Oral Implants Res 2018. 29 Suppl 16 311-330.
5. Chrcanovic, B. R., et al.; J Dent 2015. 43 (5): 487-498.
6. Schwarz, F., et al.; J Periodontol 2018. 89 Suppl 1 S267-S290.
7. Chrcanovic, B. R., et al.; Clin Oral Implants Res 2017. 28 (7): e1-e9.
8. Da Silva, J. D., et al.; J Am Dent Assoc 2014. 145 (7): 704-713.
9. Tomasi, C., et al.; J Oral Rehabil 2008. 35 (s1): 23-32.
10. Papaspyridakos, P., et al.; Int J Oral Maxillofac Implants 2012. 27 (1): 102-110.
11. Misch, C. M.; Int J Oral Implantol (New Malden) 2020. 13 (1): 3-5.
12. Jamil, F. A., et al.; BMC Oral Health 2020. 20 (1): 96.
13. Bertram, F., et al.; Int J Prosthodont 2018. 31 (2): 129-134.
14. Gallucci, G. O., et al.; Int J Oral Maxillofac Implants 2017. 32 (4): 801-806.
15. Harris, D., et al.; Clin Oral Implants Res 2012. 23 (11): 1243-1253.
16. Wismeijer, D., et al.; Clin Oral Implants Res 2018. 29 Suppl 16 436-442.
17. Fortes, J. H., et al.; Clinical Oral Investigations 2019. 23 (2): 929-936.
18. Luangchana, P., et al.; Int J Oral Maxillofac Implants 2015. 30 (6): 1287-1294.
19. Chen, S., et al.; Int J Oral Maxillofac Implants 2017. 32 (6): 1273-1280.
20. Behnia, H., et al.; Int J Oral Maxillofac Implants 2015. 30 (6): 1249-1255.
21. Van Dessel, J., et al.; Int J Oral Implantol 2016. 9 (4): 411-424.
22. Arbeitsgemeinschaft für Röntgenologie ARö; 2013. .
23. DGZMK; Dtsch Zahnärztl Z 2009. 64 (8): 490-496.
24. Schulze, D.; Dent Implantol 2014. 18 (2): 92-97.
25. Vasconcelos, T. V., et al.; Int J Oral Maxillofac Implants 2014. 29 (6): 1364-1368.
26. Vasconcelos, T. V., et al.; Int J Oral Maxillofac Implants 2019. 34 (5): 1114-1120.
27. Sancho-Puchades, M., et al.; Clinical Oral Implants Research 2015. 26 (10): 1222-1228.
28. Bover-Ramos, F., et al.; Int J Oral Maxillofac Implants 2018. 33 (1): 101-115.
29. Varga Jr., E., et al.; Clinical Oral Implants Research n/a (n/a): .
30. Chen, S., et al.; Implant Dent 2019. 28 (6): 578-589.
31. Colombo, M., et al.; BMC Oral Health 2017. 17 (1): 150.
32. Joda, T., et al.; Clin Oral Implants Res 2018. 29 Suppl 16 359-373.
33. Fuchigami, K., et al.; Clinical Oral Implants Research 2017. 28 (2): 171-176.
34. Fischer, K. R., et al.; Clin Oral Implants Res 2014. 25 (8): 894-898.
35. Fischer, K. R., et al.; Clin Oral Implants Res 2015. 26 (8): 865-869.
36. Zweers, J., et al.; J Clin Periodontol 2014. 41 (10): 958-971.
37. Alpiste-Illueca, F.; Int J Periodontics Restorative Dent 2004. 24 (4): 386-396.
38. Kan, J. Y., et al.; Int J Periodontics Restorative Dent 2010. 30 (3): 237-243.
39. Chan, H.-L., et al.; Journal of Clinical Periodontology 2018. 45 (8): 986-995.
40. Zigdon-Giladi, H., et al.; Clinical Implant Dentistry and Related Research 2016. 18 (5): 1034-1041.
41. Flügge, T., et al.; Clinical Oral Implants Research n/a (n/a): .
42. Hilgenfeld, T., et al.; Clin Oral Implants Res 2019. 30 (9): 920-927.
43. Flugge, T., et al.; Clin Oral Implants Res 2018. 29 Suppl 16 374-392.
44. Mennito, A. S., et al.; J Esthet Restor Dent 2019. 31 (4): 369-377.
45. Keul, C., et al.; Clinical Oral Investigations 2020. 24 (2): 735-745.
46. Chochlidakis, K., et al.; Journal of Prosthodontics n/a (n/a): .
47. Huang, R., et al.; Clinical Oral Implants Research n/a (n/a): .
48. Spiegelberg, F., et al.; ZZI 2019. 35 (4): 310-319.
49. Spindler, B.; Implantologie 2020. 28 (1): 63-76.
50. Läkamp, J., et al.; Funktionelle Implantologie. Chirurgische und prothetische Versorgung zahnloser Patienten. Quintessenz. 2016.
51. Michelinakis, G., et al.; Int J Implant Dent 2019. 5 (1): 19.
52. BDIZ EDI; Online resource. 2012. https://bdizedi.org/koelner-abc-risiko-score/
53. Dawson, A., et al.; The SAC Classification in Implant Dentistry. Quintessence Publishing Co. 2009.